血浆源胞外囊泡的磷蛋白组学和N-糖蛋白组学研究方法
细胞外囊泡(EVs)作为细胞间通讯的重要载体和生物标志物的重要发现来源,越来越受到重视。由于蛋白质翻译后修饰(PTMs)的状态(如磷酸化和糖基化)可能是细胞生理学的一个关键的决定因素。因此,在EVs中对蛋白质PTMs的全面描述对于疾病的早期诊断和监测尤其有价值。然而,EVs中PTMs的分析由于纯化数量有限、PTM蛋白丰度低、以及生物体液中蛋白质和代谢物的干扰而变得复杂。最近,普渡大学的研究者开发了一种方法,可以从少量的血浆中分离得到的EVs磷酸化蛋白和糖蛋白,从而能够鉴定出近10000种独特的磷酸肽和1500种独特的N-糖肽,该方法证明了通过这些潜在标志物数据可区分疾病与健康状态的可行性。
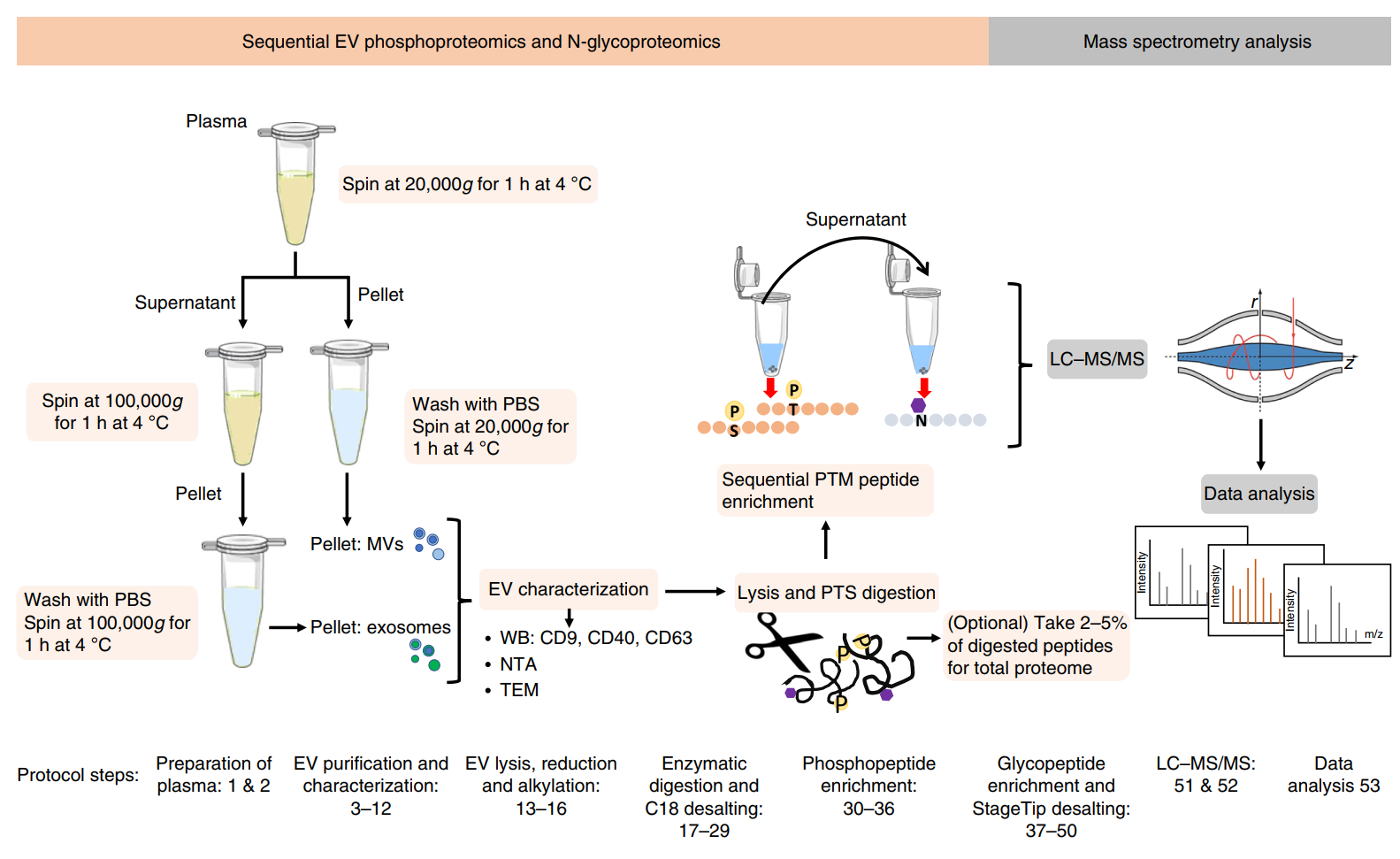
图注:EVs磷酸化蛋白组学和糖蛋白组学分析流程。EVs的分离、磷酸肽和糖肽富集以及nano LC-MS分析流程。通过连续的高速和超高速离心从人血浆中分离出囊泡及外泌体。在脱氧胆酸钠(SDC)缓冲液中裂解EVs,提取和消化蛋白。依次富集磷酸肽和N-糖肽,然后进行LC-MS /MS分析。N:天冬酰胺;P:磷酸化;S:丝氨酸;T:苏氨酸。
实验流程
一、血浆预处理 40分钟
1.离心~取2ml新鲜血液(可得血浆1 mL)于真空K2EDTA管中,1300 g, 室温离心10分钟,收集上清液。
关键步骤:根据作者经验,新鲜血浆的体积须不少于1 mL,才可以在处理过程中产生肉眼可见的沉淀颗粒(步骤7)并实现PTM分析及定量。为获得1 mL新鲜血浆,所需新鲜血液的体积最好不少于2 mL。另根据作者经验,1 mL血浆可以得到20-100μg的蛋白;同时,蛋白的提取效率也受样本来源、疾病和其他因素的影响。对于需要三次重复的样本,我们建议将初始血浆量增加三倍(3 mL),以便有足够的样本进行定量。
2.在室温条件下,将上清以4000 g离心15分钟,收集上清液;~1 mL。
关键步骤:在血沉棕黄层上保留30-50 μL血浆,避免污染。
样品保存:血浆样品可以在-80°C保存1-2年。使用前可于37°C的水浴中解冻。
二、外泌体纯化 3-4小时
3. 在4°C条件下,将血浆样品以20,000 g离心1小时。
4. 收集上清用于外泌体纯化,并将样品始终置于冰上,直到步骤8。按照步骤5-7来分离细胞微泡(MVs); 否则,直接进入步骤8。
5用PBS重悬沉淀(与步骤2体积相同)。
6. 重选液于4°C条件下离心,20,000 g,1小时。
7. 弃上清,沉淀内即含有MVs。
关键步骤:确保得到一个完整的,固体小颗粒,避免污染。小心地吸取上清。
样品保存:MVs沉淀可以在-80°C保存一周。
8. 将步骤4得到的外泌体上清在4℃条件下,100,000g离心1小时。
9.弃上清,用1 mLPBS重悬沉淀。
10. 在4℃条件下,100,000g离心1小时。
11. 弃上清,沉淀内即含有外泌体。
关键步骤:外泌体不像MVs在管底明显可见;确保在靠近沉淀可能在的位置小心地吸取上清(大多数时候沉淀肉眼不可见)。
样品保存:外泌体沉淀可在-80°C保存一周。
三、EVs鉴定 时间不可预计
12. 一般情况下用蛋白质印迹法(WB)利用抗原抗体结合的方式来检测EVs的标志蛋白(如,CD9、CD63、CD81、α-actinin-4、CD40和mitofilin);用纳米颗粒跟踪分析技术(NTA),可控电阻式脉冲传感技术(TRPS)和动态光散射(DLS)对外泌体粒径分布和浓度进行分析;此外,还可用电子显微镜(TEM, cryo EM)或原子力显微镜(AFM)直接观察确定外泌体大小和形状。
四、EVs裂解,还原和烷基化 10-20分钟
13. 用100 µL EVs裂解、还原和烷基化缓冲液重悬外泌体和MVs,使其溶解。
关键步骤:根据后续需要,可将外泌体和MVs合并或分开提取。因为EVS具有粘性,在EVs裂解、还原和烷基化缓冲液内吸打易形成气泡,因此,在合并时须小心,避免气泡过多形成,造成样本损失。
关键步骤:不添加蛋白酶抑制剂,因为他们可抑制Lys-C和胰蛋白酶的酶切效率(步骤17-18)。
14. 溶解后,将样品在95°C加热5分钟。
15. 加入400 µL胰蛋白酶缓冲液,将烷基化蛋白稀释五倍。
16. BCA检测蛋白质浓度
关键步骤:BCA测定浓度时,用胰酶缓冲液将稀释的EV裂解、还原和烷基化缓冲液稀释五倍作为空白组。
关键步骤:通常情况下可以从1 mL血浆样本中提取到60 µg外泌体蛋白,我们一般认为大约有1%的肽段被磷酸化/糖基化。
关键步骤:将2%-5%的肽段(约1µg肽段 )转移至新的试管中,用于后续单独的蛋白质组学分析。剩下的肽段样本用于后续的磷酸化肽段和糖基化肽段的富集。
五、酶切 16-18小时
17. 在37°C下,以1:100(wt/wt)的酶/蛋白质比例用Lys-C消化20–100 µg样品3小时。 总体积应为500 μL。
18. 以1:50(wt/wt)酶/蛋白质比例添加胰蛋白酶,并在37°C下孵育过夜。
19. 以终浓度5%(vol/vol)添加TFA,酸化消化的肽,并向500 μL的消化溶液中添加500 μL乙酸乙酯。
20. 将溶液Vortex 2分钟,然后在室温20,000 g离心2分钟,以获得水相和有机相。丢弃最上面的有机层。
关键步骤:小心地移开上层,不要破坏下层或中间相,避免污染。
21. 重复步骤19-20,尽可能多地去除洗涤剂残留物(添加乙酸乙酯,Vortex后弃上层有机物;不要再添加TFA)。收集水相层并在真空离心机中干燥。
样品保存:可以在-80°C保存3个月。
六、C18脱盐 1小时
关键步骤:柱子的选择取决于EVs蛋白的数量及实验设计。 1 mL 提取出的EVs通常可以获得 20-100 μg蛋白质,作者使用50-mg柱子,可以为500 μg肽段脱盐。
22. 用1 mL缓冲液复溶步骤21的干燥样品,用Sep-Pak脱盐。
23. 向小柱内加入1mL甲醇调节脱盐环境。
关键步骤:避免空气进入。
24. 加入1 mL缓冲液B平衡。
25. 加入1 mL缓冲液A洗脱。
26. 缓慢将样本加入小柱内,再加入1 mL 缓冲液A。
27. 每次用1 mL缓冲液A洗脱,重复3-5次。
28. 加入1 mL缓冲液B将样本洗脱下来。取2-5%进行蛋白质组学分析。剩余样本进行磷酸化和糖基化富集。
29. 用真空离心法将蛋白质组学分析样本及修饰蛋白质组学样本进行干燥。
样品保存:两种样本均可以在-80°C保存3个月。
七、磷酸化肽段的富集 1-2小时
作者使用Spin-Tip PolyMAC-Ti kit来富集磷酸化肽段。有多种可以选择的磷酸化富集方法,实验体系可进行适当调节(原文步骤30-36)。
八、糖基化肽段富集 约8小时(原文步骤37-44)
九、糖肽的StageTip脱盐 1小时(原文步骤45-50)
十、LC–MS/MS检测 1小时
51. 用4.5 μL MS上样缓冲液复溶干燥的肽段(全谱蛋白质组,磷酸化富集肽段及糖基化富集肽段)后,加入Easy-nLC 1000 LC中。
52. 质谱上机检测。
十一、数据分析 >1天
53. 用Proteome Discoverer软件进行蛋白ID分析,用MaxQuant进行定量及皮尔森得分分析。
关键步骤:对于MaxQuant和Proteome Discoverer来说,通常默认设置即为理想的,除了可变修饰外,大多数设置都没有改变。
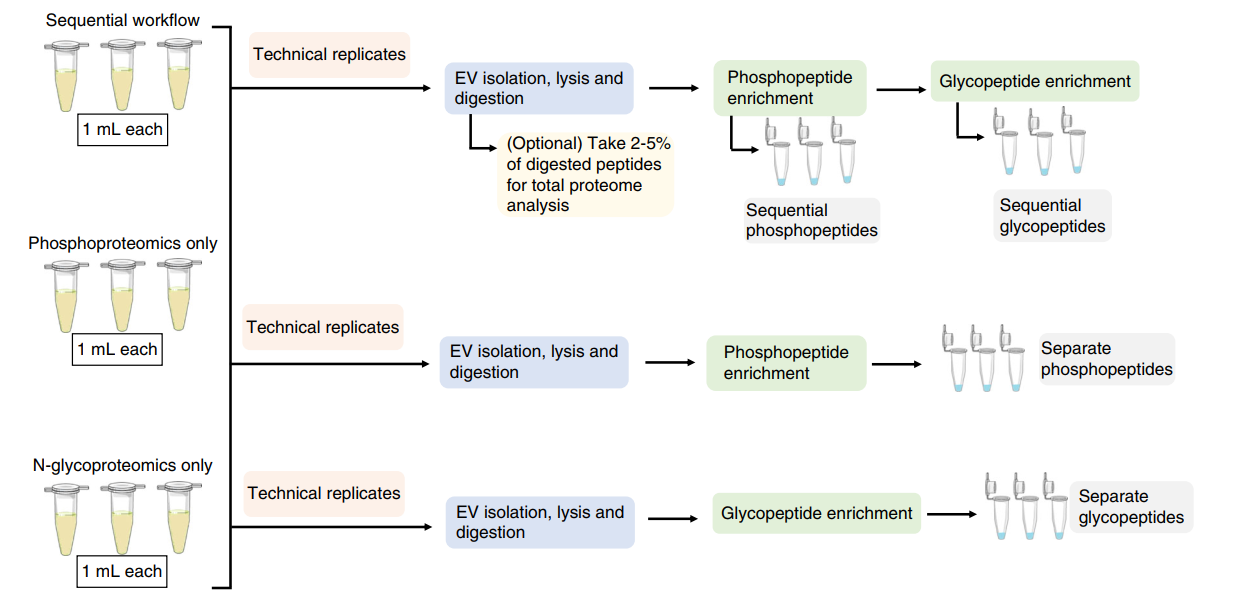
图注:磷酸肽和糖肽连续富集和单独富集实验示意图。

图注:维恩图显示了重复之间的磷酸肽和磷蛋白重叠,以及单独和连续工作流程之间的重叠。
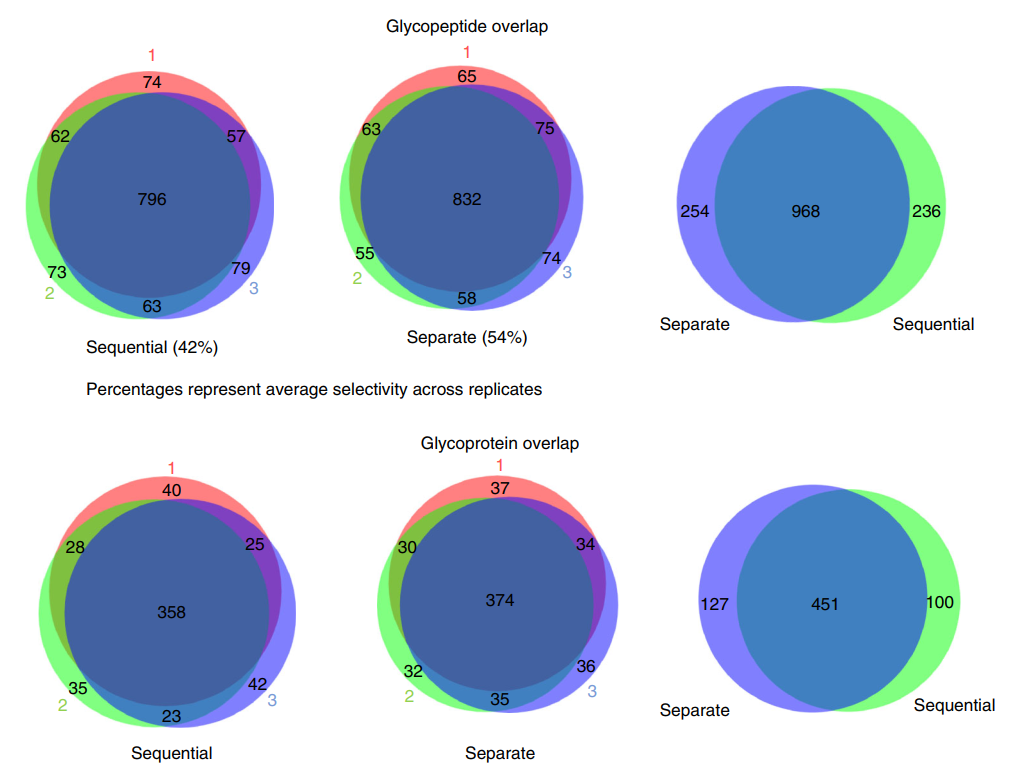
图注:维恩图显示了重复之间的糖肽和糖蛋白重叠,以及单独和连续工作流程之间的重叠。
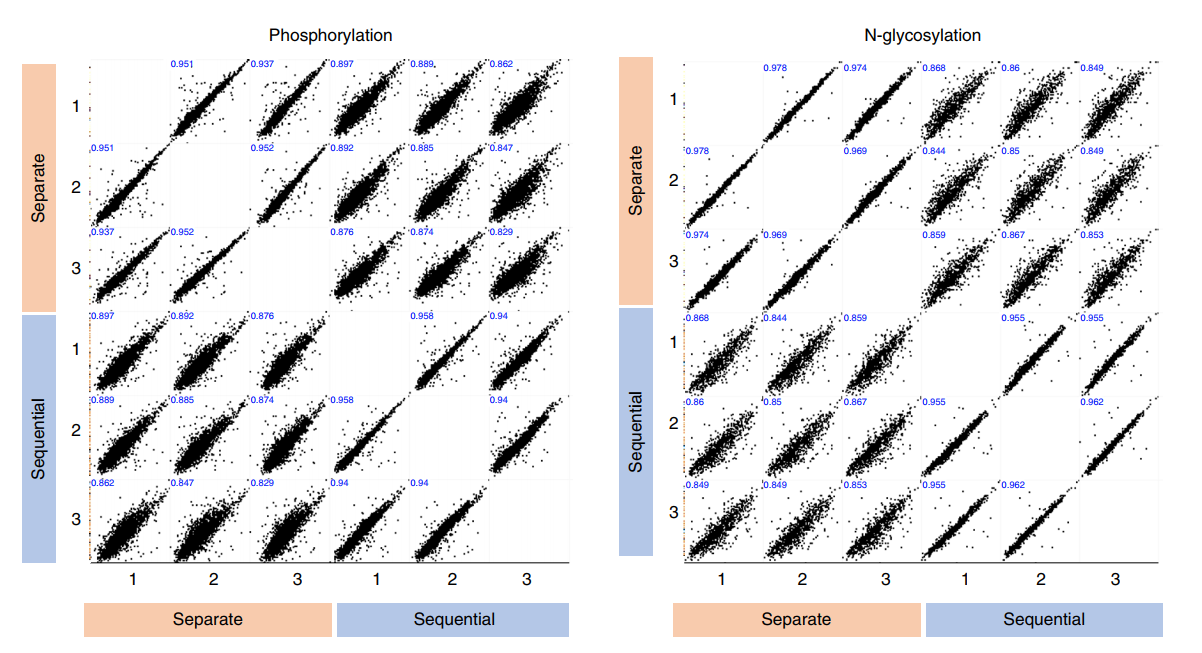
图注:MaxQuant的定量结果和不同条件及重复间的Pearson相关性。
参考文献:Hillary Andaluz Aguilar, Anton B. Iliuk, I-Hsuan Chen & W. Andy Tao. Sequential phosphoproteomics and N-glycoproteomics of plasma-derived extracellular vesicles. Nature Protocols 2019 Dec 20. doi: 10.1038/s41596-019-0260-5.
