以下文章来源于外泌体之家 ,作者土豆
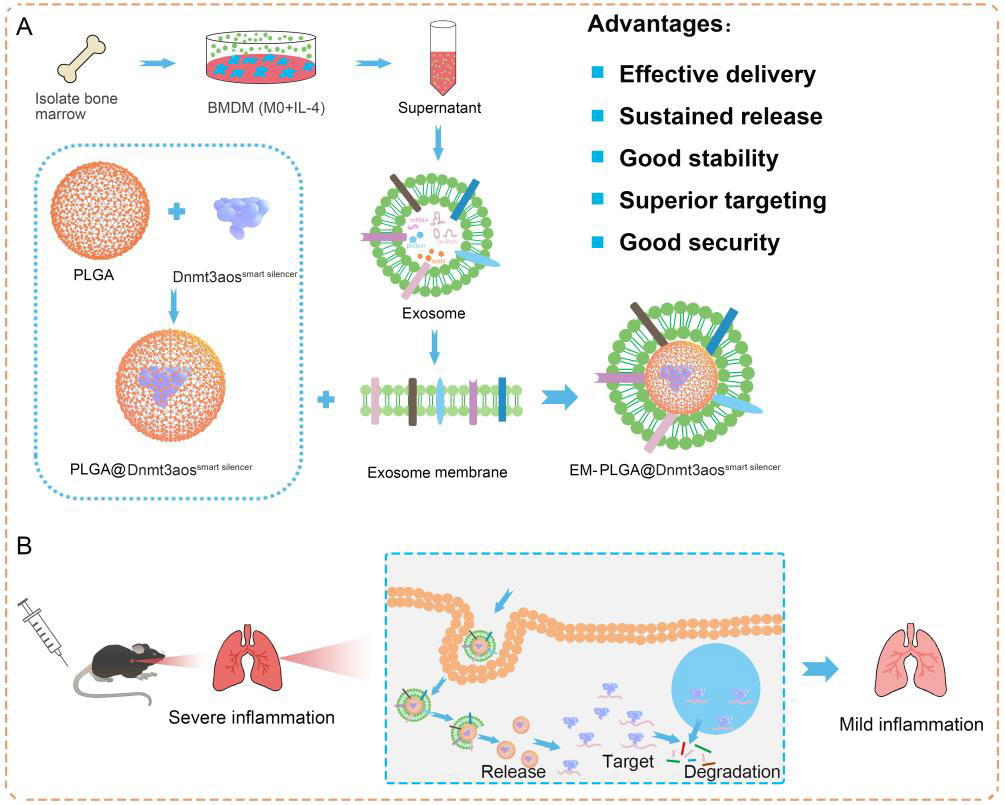
本文外泌体是天然分泌的纳米囊泡,由于其特定的组成、生物学特性和稳定性,已成为有前途的治疗性纳米递送平台。来自皖南医学院吕坤课题组的研究人员开发了一种利用M2巨噬细胞的外泌体膜和Dnmt3aos沉默结构包裹的聚乳酸乙醇酸共聚物(PLGA)纳米颗粒(EM-PLGA@Dnmt3aossmart),用于治疗小鼠的过敏性哮喘,为过敏性疾病提供了一种新的免疫疗法。该研究发表于Journal of Controlled Release杂志上。全球有超过3亿人患有哮喘,据估计到 2025 年将影响4亿人,过敏性哮喘 (allergic asthma,AA) 占儿童哮喘病例的 90% 和成人哮喘病例的50%。巨噬细胞是肺部最丰富的免疫细胞(约占所有免疫细胞的70%),在AA中环境过敏原诱导的气道炎症中发挥重要作用。M2巨噬细胞过继转移的研究表明,该策略可有效加重小鼠过敏性气道炎症,表明M2巨噬细胞极化在 AA 的发生中起重要作用。因此,开发专门针对 M2 巨噬细胞的新策略被认为是治疗AA的更有希望的方法。 在此前研究中,数以千计的长链非编码RNA (lncRNA) 在 M1/M2 极化骨髓源巨噬细胞 (BMDM) 中差异表达。其中,Dnmt3aos是一种已知的lncRNA,位于Dnmt3a的反义链上。该研究团队此前已经证明 Dnmt3aos 在 M2 巨噬细胞中高表达并参与调节 Dnmt3a 的表达。Dnmt3aos 和 Dnmt3a 的表达具有一致性,并且在巨噬细胞极化中起关键作用。因此,M2 巨噬细胞中的 Dnmt3aos 是AA的良好治疗靶点,但其在AA中的作用尚不清楚。由三个小干扰 RNA (siRNA) 和三个反义寡核苷酸 (ASO) 组成的智能干扰结构在介导给定目标基因的序列特异性沉默方面发挥着重要作用。由于它们的不稳定性、有限的细胞摄取和不令人满意的血液循环,游离ASO/siRNA 在临床治疗中几乎无法发挥作用。为了克服 ASO/siRNA 递送的障碍,高效和安全的递送载体对于ASO 或 siRNA 疗法的研究和生产至关重要,例如基于脂质的颗粒和混合纳米颗粒 (NPs)。由于其良好的生物降解性和生物相容性,欧洲药品管理局 (EMA) 和美国食品和药物管理局 (FDA) 已批准使用聚乳酸乙醇酸 (PLGA) 共聚物用于药物和生物分子递送、生物可吸收缝合线、生物成像和组织再生。具体而言,负载有 siRNA 的 PLGA NPs 表现出缓释特性,在第一天释放 35% 的 siRNA,并表现出超过10天的缓释。因此,PLGA包裹的Dnmt3aos智能干扰结构对靶细胞的持续消耗和调控十分有价值。 随着纳米载体的快速发展,出现了新的药物/基因递送载体,例如细胞来源的外泌体,具有优异的靶向性。从亲本细胞自然遗传的表面粘附蛋白和特定的载体配体赋予外泌体器官趋向性,可用于货物传递。作为天然载体,外泌体可以将外源性 miRNA 或 siRNA 递送至体内靶细胞或组织,以调节基因表达和抑制疾病进展。然而,常规用基因转染细胞的方法并不适用,因为外泌体中基因的表达较少。最近的一项研究也证明,当电穿孔诱导siRNA进入外泌体时,siRNA很容易降解。研究表明,某些 NPs 可以与 siRNA 或 ASO形成复合物。这种纳米复合物的形成对于完全保护RNA、防止其降解和通过内吞作用和细胞内释放实现细胞递送非常重要。因此,为了进一步提高NPs的生物分布、稳定性、功效和生物相容性,迫切需要建立基于外泌体修饰的PLGA NPs,形成结合两种系统优点的复合物。在这项研究中,研究人员探索了由 PLGA@Dnmt3aossmart 干扰结构为核心和外泌体膜组成的M2 巨噬细胞的外泌体膜包被的仿生纳米粒子(EM-PLGA@Dnmt3aossmart)。EM-PLGA@Dnmt3aossmart抑制AA中M2巨噬细胞极化的效果显著,仿生纳米颗粒有效地积聚在肺部并促进基因沉默,同时降低了气道炎症细胞浸润的程度。基于外泌体膜的 PLGA NPs 有助于将治疗性 Dnmt3aossmart输送到气道中,并可以在AA 小鼠模型中提供有效的治疗。